Friedrich Wöhler (1800-1882)

Nacimiento: 31 de julio de 1800 Alemania
Fallecimiento: 23 de septiembre de 1882 Gotinga, Alemania
Trabajos como profesor
Aportes
Trabajos como profesor
Aportes
Fue Pedagogo y químico alemán, precursor en el campo de la química orgánica, mejor conocido por su síntesis de la urea, además de aislar varios elementos químicos.
Nació en Eschersheim, actualmente Frankfurt am Main en Alemania.A muy temprana edad mostró una pasión por la ciencia. La familia se muda a Francia en 1812, donde se unió a la escuela secundaria y estaba bajo la influencia del doctor Bucha, donde aumenta su inclinación por las ciencias naturales. En 1820 se trasladó a Marburgo, donde ingresó en la Facultad de Medicina de la Universidad de Gdansk. Para 1823 Wöhler termina sus estudios de Medicina en Heidelberg en el laboratorio de Leopold Gmelin, donde piensa en convertirse en médico práctico, pero su profesor lo convence de irse a estudiar a Estocolmo, donde se convierte en el ayudante del químico alemán Jöns Jakob Berzelius, con quien crea una gran amistad.
En los años 1826 hasta el 1831, enseñó química en la Escuela Politécnica de Berlín. Posteriormente, se convirtió en profesor ordinario de química en la Universidad de Gotinga, donde además dirigía en esta ciudad el Instituto de Química. En 1834, fue elegido miembro extranjero de la Real Academia de Ciencias Sueca.
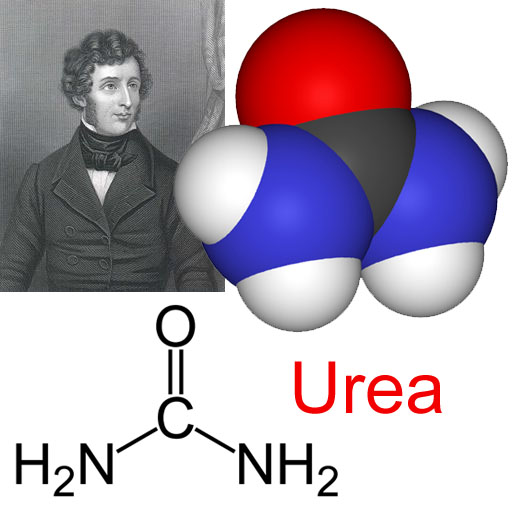
Wöhler también era conocido por ser el co-descubridor del berilio, silicio y nitruro de silicio, así como la síntesis de carburo de calcio, entre otros. En 1834, Wöhler publicó una investigación sobre el aceite de almendras amargas con Liebig Justus. Probaron por sus experimentos que un grupo de Carbono, hidrogeno y oxigeno, los átomos puede comportarse como un elemento, toman el lugar de un elemento, y pueden ser intercambiados para los elementos en compuestos químicos, así la fundación fue puesta de la doctrina de radicales compuestos, una doctrina que tenía una influencia profunda en el desarrollo de la química. Desde el descubrimiento de potasio por Humphry; Davy, Oerstedt y Berzelius intentaron la extracción de este metal, pero no se pudo. Wöhler entonces trabajó sobre el mismo tema, y descubrió el metal de aluminio en 1827. A él también se debe al aislamiento de los elementos itrio, berilio y titanio, la observación de que "silicio" se puede obtener en los cristales y que algunas piedras meteóricas contienen materia orgánica. En 1830 determinó que el elemento eritronio descubierto por Andrés Manuel del Rio en Mexico en 1801 y el vanadio descubierto por Nils Gabriel Sefström en Suecia 30 años después, eran el mismo. Wöhler y Sainte Claire Deville descubrieron la forma cristalina del Boro, y Wöhler y Buff Heinrich descubrió silano en el año 1857. Wöhler también preparó urea, un componente de la orina, a partir de cianato de amonio en el laboratorio sin la ayuda de una célula viva. También desarrolló el método para preparar el fósforo que se sigue utilizando en la actualidad. Los descubrimientos de Wöhler tenían gran influencia en la teoría de la química. Los diarios de cada año a partir de 1820 a 1881 contienen contribuciones de él. También escribió varios libros de texto de quimica organica e inorganica.
Wöhler descubre por casualidad que al calentar una sal (cianato amónico) se obtenía urea, que era un producto excretado por los animales ya conocido por aquel entonces. Esta fue la primera síntesis de un compuesto orgánico a partir de sustancias inorgánicas, dando un duro golpe a la teoría del vitalismo.
Años más tarde, Kölbe y Berthelot lograron sintetizar moléculas orgánicas sencillas a partir sustancias elementales inorgánicas, demostrando que no es necesaria ninguna fuerza vital para obtener compuestos orgánicos. Berthelot fue capaz de sintetizar una grasa calentando glicerol con ácido esteárico, comprobando que la primera grasa sintética era idéntica a la triesterina obtenida de las grasa naturales. Estos descubrimientos pusieron fin a la teoría del vitalismo.

Hosni Benavides
Juan Pablo Garzon





